|
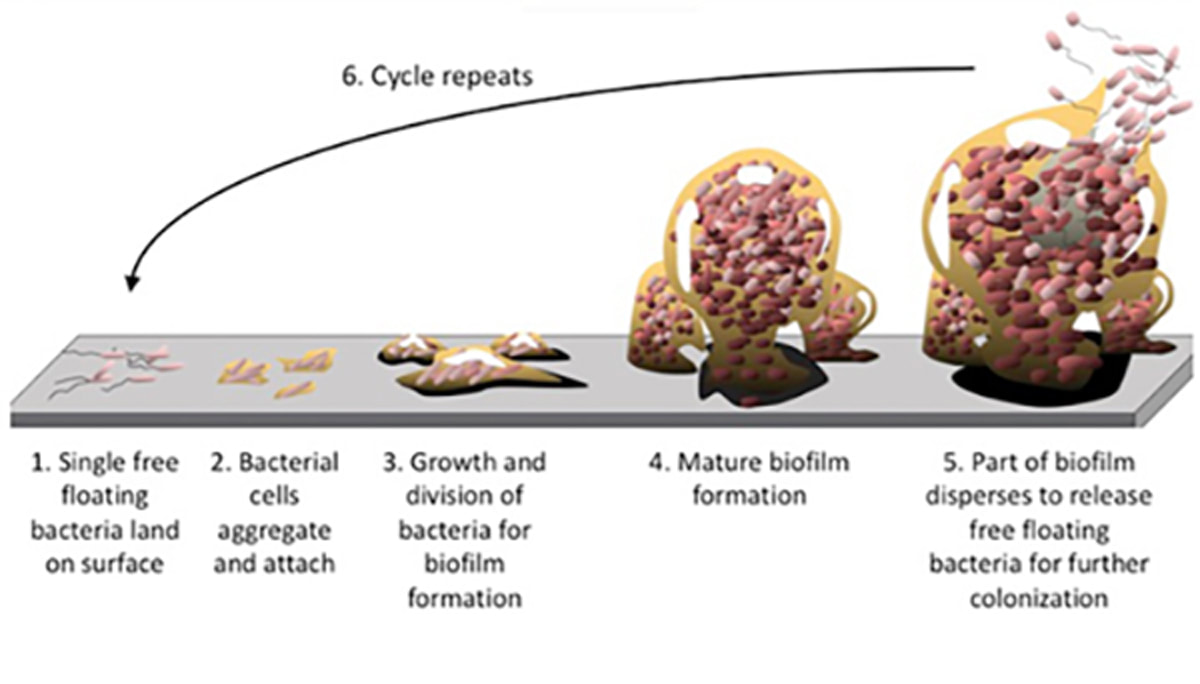
La N-acetilcisteína (NAC) es bien reconocida como antioxidante y precursora del glutatión. Como tal, a menudo se prescribe para tratar afecciones asociadas con la sobrecarga tóxica (por ejemplo, sobredosis de paracetamol), estrés oxidativo y disfunción inmune.Haz clic aquí para editar. Basado en su papel como precursor del antioxidante glutatión, y su acción como agente modulador de las vías glutamatérgicas, dopaminérgicas, neurotrópicas e inflamatorias, NAC ha mostrado beneficios prometedores en trastornos psiquiátricos, incluyendo adicción/abuso de sustancias, [1] autismo, trastornos del espectro compulsivo-obsesivo, esquizofrenia, depresión y trastorno bipolar. [2] Se ha demostrado que NAC ayuda a mejorar la fertilidad en pacientes con síndrome de ovario poliquístico (PCOS) a 1200-1800 mg diarios en dosis divididas, [3,4] y es útil también en el trastorno pulmonar obstructivo crónico (EPOC) a dosis de 600 mg. dos veces al día. [5] Los mecanismos de acción de NAC en el manejo de la EPOC incluyen sus acciones antioxidantes e inflamatorias para ayudar a minimizar la inflamación de las vías aéreas locales, junto con sus beneficios mucolíticos. NAC es capaz de romper el enlace disulfuro en el monómero de mucina, reduciendo finalmente la viscosidad mucosa. Además, el antioxidante tiene un efecto mucoregulador, inhibiendo la hiperplasia de las células secretoras de mucosa [6,7] y reduciendo la expresión del gen MUC5AC (implicado en la secreción mucosa). [7] Además, el glutatión es esencial para el funcionamiento de células inmunes específicas y, a través de su papel de apoyo a la síntesis saludable de glutatión, el NAC puede ayudar a minimizar el riesgo de infección. Es el papel mucolítico de NAC, en combinación con influencias adicionales sobre el estrés oxidativo que parecen hacerlo útil en infecciones persistentes resistentes a los antibióticos. La investigación demuestra que NAC se puede usar en combinación con antibióticos u otros agentes antimicrobianos para mejorar la susceptibilidad de las colonias bacterianas patógenas a los efectos de tales tratamientos. ... dependiendo del organismo y el tipo de sistema antimicrobiano y experimental, las bacterias-biofilm pueden ser hasta mil veces más resistentes al estrés antimicrobiano que las bacterias de la misma especie que nadan libremente. ¿Qué hace que una infección persista?Una forma clave en la que una infección se vuelve persistente (por ejemplo, Helicobacter pylori resistente a los medicamentos, infecciones crónicas del tracto respiratorio superior y gastrointestinal) es a través de la formación de biopelículas. Estas biopelículas pueden proteger a las colonias microbianas de la exposición al medio ambiente (incluido el sistema inmunitario) y los agentes antimicrobianos (por ejemplo, antibióticos, hierbas antimicrobianas), al tiempo que ayudan a la colonia a adherirse a una superficie. De hecho, dependiendo del organismo y el tipo de sistema antimicrobiano y experimental, las bacterias biofilm pueden ser hasta mil veces más resistentes al estrés antimicrobiano que las bacterias de la misma especie que nadan libremente. [8] Se estima que el 60% de todas las infecciones humanas y el 80% de las infecciones refractarias/crónicas (es decir, que no responden al tratamiento médico) son atribuibles a las colonias de biopelículas. [9] Cuando se trata de infecciones crónicas, ha quedado claro a través de la investigación que las bacterias pueden persistir en las superficies mucosas mediante la formación de estas biopelículas; Curiosamente, las biopelículas se consideran las formas de vida más ubicuas y exitosas en la tierra. [10] La biopelícula es una matriz de sustancia polimérica extracelular (EPS) que se compone de una amplia variedad de materiales, incluidos polisacáridos, proteínas, ácidos nucleicos y lípidos. [10] El proceso general de formación de biopelículas implica la adhesión de bacterias de vida libre o "planctónicas" a una superficie, que posteriormente se convierten en microcolonias y forman una biopelícula. A medida que la biopelícula continúa creciendo, pueden suceder varias cosas; la biopelícula puede extenderse a áreas no infectadas según lo permitan las condiciones ambientales y, ocasionalmente, las células se desprenderán de la biopelícula y volverán a ingresar en un modo planctónico (es decir, "natación libre ''). Estas células planctónicas pueden repetir el ciclo e infectar nuevas superficies (figura 1). [11] Figura 1. Formación de biofilm y ciclo de dispersión. Existen múltiples sustancias naturales que se han identificado como útiles para la inhibición y/o alteración de las biopelículas, y estas incluyen berberina [12] (p. Ej., Del sello dorado y el hellodendro), ácido elágico (p. Ej., De la granada) [13], así como enzimas proteolíticas como la serrapeptasa. [14] Además, se observa que NAC no solo es un agente mucolítico (útil para descomponer los componentes viscosos de la biopelícula), sino que también posee la capacidad de reducir la producción de EPS y promover la interrupción de las biopelículas maduras. [15 ] COMUNICACIÓN BACTERIANA OBJETIVOUn paso importante involucrado en la formación bacteriana de microcolonias, su virulencia y la formación de biopelículas, es la liberación de productos químicos de detección de quórum. En pocas palabras, la detección de quórum es un proceso a través del cual las bacterias se comunican para determinar la densidad de la población local. Una vez que las sustancias de detección de quórum alcanzan una cierta concentración (debido a las altas poblaciones de microbios similares), esto es detectado por los habitantes y puede provocar la activación de la transcripción de genes dentro de los microorganismos. Esta expresión génica ve la "activación" de los factores de virulencia (por ejemplo, la liberación de toxinas dañinas), o puede comenzar el proceso de microcolonia y la posterior formación de biopelículas. [16] Debido a la creciente preocupación por la resistencia a los antibióticos, los investigadores también buscan comprender no solo qué sustancias pueden usarse para inhibir y alterar las biopelículas, sino también qué pueden poseer la capacidad de inhibir la detección de quórum. NAC ha demostrado en estudios anteriores, la capacidad de inhibir los químicos que detectan el quórum para prevenir el desarrollo de infecciones (por ejemplo, Pseudomonas aeruginosa que comúnmente infecta a los pacientes con fibrosis quística). Se sugiere que esta función se debe a las capacidades antioxidantes de NAC. Las especies reactivas de oxígeno parecen ser responsables de activar las vías de detección de quórum, lo que se inhibe por la capacidad del NAC de suprimir la actividad de peróxido de hidrógeno y los reguladores maestros de detección de quórum. Este efecto sobre el peróxido de hidrógeno también fue capaz de inhibir la liberación de toxinas de P. aeruginosa, ya que los factores de virulencia como la secreción de toxinas también son estimulados por el estrés oxidativo. [17] NAC Y RESISTENTE AL TRATAMIENTO H. PYLORILa triple terapia estándar que consiste en inhibidores de la bomba de protones (IBP), amoxicilina y claritromicina, se ha recomendado durante mucho tiempo como terapia de primera línea para la infección por H. pylori. Sin embargo, la tasa de erradicación de esta triple terapia ha disminuido debido al aumento de la resistencia a los antibióticos. [18] En dos ensayos controlados aleatorios sobre H. pylori, el tratamiento previo con NAC, antes de una terapia con antibióticos contra las biopelículas mediadas por H. pylori, mostró que NAC logró un aumento en la permeabilidad del tratamiento con antibióticos, lo que resultó en la superación de la resistencia a los medicamentos y la erradicación de pre biopelículas formadas. Además, se observó una reducción en el grosor del moco de la barrera gástrica y una reducción de la viscoelasticidad del moco. INFECCIONES CRÓNICAS DEL TRACTO RESPIRATORIO SUPERIORNo sorprende que las biopelículas desempeñen un papel importante en la otitis media crónica (infecciones del oído), sinusitis, amigdalitis y adenoiditis (adenoides infectadas). Se han llevado a cabo estudios sobre el uso y la eficacia de NAC en la descomposición de las biopelículas relacionadas con los culpables patógenos de estas condiciones persistentes, y se ha demostrado que NAC, utilizado en diferentes concentraciones, puede reducir la adhesión bacteriana en varios de estas áreas, haciendo de NAC una consideración importante en casos crónicos. [19] P. aeruginosa es un patógeno común en infecciones crónicas del tracto respiratorio (particularmente en pacientes con fibrosis quística (FQ)). Por lo general, produce una biopelícula, lo que dificulta el tratamiento de la infección. En un estudio que investiga los efectos inhibitorios de NAC en las biopelículas producidas por P. aeruginosa, los resultados demostraron que NAC posee propiedades antibacterianas contra el patógeno y puede desprender las biopelículas de P. aeruginosa. Por lo tanto, se sugiere que la NAC puede ser una nueva estrategia para el tratamiento de infecciones respiratorias crónicas asociadas a biopelículas debido a P. aeruginosa, y se justifica la investigación adicional. [20] CARIES DENTALLa placa dental es una de las formas de biofilm más obvias y difíciles de tratar. Como compuesto con un amplio margen de seguridad, NAC ha demostrado el potencial como terapia para ser utilizado como un agente antiplaca y bacteriostático para controlar la caries dental crónica. El beneficio potencial de anticaries de NAC está directamente relacionado con la reducción de la cobertura de biopelículas que reduce el grado de generación de ácido y la cantidad de tiempo que la superficie está expuesta al pH más bajo. [21] CONCLUSIÓNEn conclusión, NAC representa una consideración interesante para promover la resolución de infecciones persistentes que pueden haber resistido previamente a los tratamientos antimicrobianos estándar. No solo demuestra la capacidad de interferir con la comunicación bacteriana y la supresión de los factores de virulencia, sino que también inhibe la formación de biopelículas, interrumpe las biopelículas maduras, ayuda a la descomposición de la mucosidad y proporciona beneficios locales antiinflamatorios y antioxidantes. Referencias
6 Comentarios
18/1/2021 08:49:50 pm
Doctor Méndez:
Responder
Alberto Méndez
19/1/2021 11:09:45 am
Entre 600 y 1.800 miligramos de NAC al día parece ser eficaz contra muchas enfermedades; Cápsulas de 600 miligramos tomadas dos o tres veces al día es la dosis recomendada para empezar.
Responder
rebeca mejias
16/2/2023 02:56:00 am
Y ¿ Cómo se debe tomar el nac para el biofilm bucal? ¿En enjuagues? Gracias
Responder
Israel
21/3/2021 05:20:51 pm
Hola. ¿El NAC sería adecuado para el uso de una chlamydia trachomatis que ha resistido a los antibióticos? Podría combinarse con tratamientos antibióticos prolongado? Y cuál sería la dosis diaria? Muchas gracias!
Responder
Alberto Méndez
24/3/2021 01:06:31 pm
Hola, sí. 600 miligramos tomadas dos o tres veces al día es la dosis recomendada para empezar.
Responder
Lídia
21/3/2021 06:47:28 pm
Me puede decir por favor si NAC es bueno para contrarrestar la sinusitis?
Responder
Deja una respuesta. |
Archivos
Mayo 2020
Categorías |